”Men patienten har KOL – ska vi verkligen ge syrgas?”
Ord som många har tänkt, sagt eller hört. Men varför retinerar KOL-patienter? Många lär sig att syrgastillförsel gör att KOL-patienten slutar andas – men så enkelt är det inte!
Här kommer 5 minuters läsning som kommer att blåsa hål på myten, få dig att känna dig riktigt KOL, och få dig att tröttna på respiratoriska ordvitsar. Så ta ett djupt andetag…
Andningsfysiologi – superkort repetition
Flera faktorer påverkar hur vi andas, men största effekten på minutventilationen kommer från centrala kemoreceptorer i hjärnstammen som känner av CO2-nivåerna i blodet. [Spyer 2009] Grundinställningen är: Högt pCO2? Dags att andas mera! (Ja, jag sammanfattar andningsfysiologin med två meningar, medveten om att jag nog kommer få arga mail från andningsfysiologer). Men hur är det för KOL-patienter?
The Donald: de andas för lite
1949 skickade Kenneth Donald in ett brev till the Lancet [Donald 1949]. Han beskrev en man som efter 12 timmars syrgasbehandling hade ett pCO2 på 16kPa och var komatös, och som sedan vaknade till när man slutade ge syrgas:
”It was indeed a strange sight to see him become almost black and then recover consciousness.”
Primum non nocere.
Varför är det här brevet viktigt? Jo, Donald föreslog han att den huvudsakliga mekanismen var att KOL-patienter har en hypoxisk drive (alltså att deras andnings drive styrs mer av pO2 snarare än pCO2) och om man ger syrgas till dem minskar ventilationen:
”The removal of the anoxic stimulus causes them to hypoventilate with further retention of carbon dioxide.”
Men är sänkt minutventilation verkligen hela sanningen?
80-talet – inte bara minutventilation
Man trodde att minutventilationen var den enda mekanismen, men på 60-talet började forskare studera blodgaser systematiskt på KOL-patienter [McNicol 1965], och väckte misstanken att den pulmonella cirkulationen sannolikt var inblandad [Campbell 67]. Artikeln innehåller f.ö. många bra citat som t.ex:
”Better a year at a pO2 of [6.6 kPa] than an hour at a pO2 of [2.6 kPa]”
Hypoxisk pulmonell vasokonstriktion (HPV) är ett sätt för lungan att optimera gasutbytet. I de alveoler som inte ventileras väl drar blodkärlen ihop sig, så att mer blod slussas till de alveoler där det finns gas att utbyta. Hos KOL-patienter finns det många alveoler som är rätt skadade, varför det konstant kan finns en viss grad av HPV. När man tillför syrgas kan dock HPV:n slås ut, även i de delar av lungan som inte fungerar så bra, vilket ger upphov till dead space.
En fransk forskargrupp på 80-talet förstärkte att hyperkapnén delvis orsakades av HPV. De tittade på 20 patienter med avancerad KOL och exacerbationer, och såg att hyperkapnén inte kunde förklaras av en minskad minutventilation, utan snarare av en ökning i fysiologisk deadspace genom dysfunktionell ventilation/perfusions-matching [Aubier 1980], vilket styrktes av andra forskare [Sassoon 1987], [Dick 1997]. Alltså att syre diffunderar passivt till icke-ventilerade alveoler, vilket gör att vasokonstriktionen där slås av. Då kommer icke-syresatt blod med mycket koldioxid kommer till alveoler som inte ventileras, och då har vi en ventilations/perfusions-missmatch. År 2000 utmanades dock detta av en australiensisk studie som tittade på KOL patienter. De såg att hos patienter som retinerade så minskade ventilationen påtagligt, det vill säga att minutventilationen visste spelade roll [Robinson 2000]. Det finns flera möjliga förklaringar till varför studierna skiljde sig åt, men sammantaget är det sannolikt så att minutventilationen spelar roll, men olika mycket i olika KOL-patienter.
Intressant nog så föreslog Aubier et al redan på 80-talet att hyperkapnén berodde på en syrgasinducerad minskning i andningsfrekvens, en försämrad ventilations/perfusionsmatching samt Haldaneeffekten. Vänta – Haldaneeffekten?
Haldaneffekten
1914 beskrev två forskare (varav en hette Haldane) att Hb kan binda mer CO2 i sitt deoxygenerade tillstånd, än i dess oxygenerade. När man tillför syrgas blir mer Hb oxygenerat, och kan således binda en mindre mängd CO2, vilket ökar pCO2. [Haldane 1914] Det är dock lite oklart hur stor roll Haldaneffekten har på att orsaka hyperkapnén – vissa efterföljande studier har antytt en liten roll [Lenfant 1966], och andra en större roll [Luft 1981].
Hur tolkar vi allt detta?
Det är svårt att försöka studera ett komplext heterogent fenomen (hyperkapné hos KOL patienter vid syrgastillförsel). Som vi sett har det studerats ur många olika vinklar, med stundom motsägelsefulla fynd, och då de flesta studier skiljer sig åt i metodologi och sammanhang är det svårt att vara säker på hur man bäst värderar fynden gentemot varandra. Vissa av studierna gjordes på KOL patienter, andra på KOL patienter i exacerbationer, vissa bara på patienter med grav KOL – och man har gett olika mycket syrgas, och ibland använt munstycken för att mäta minutventilation (en metod som i sig har felkällor).
En viktig lärdom är att det inte bara är KOL-patienter som retinerar. Patienter med neuromuskulära sjukdomar, eller hypoventilation till följd av obesitas, kan också ha en kronisk HPV, eller försämrat alveolärt gasutbyte, och kan då också retinera vid syrgastillförsel [Budinger 2013, Gay 1995].
Sannolikt kommer det komma fler studier framöver som hjälper oss förstå de underliggande mekanismerna, men det är nog klokt att var ödmjuk inför att vi idag sannolikt inte har alla svaren. Med det sagt, vissa saker kan vi vara rätt säkra på.
Sammanfattning
Förutom att ge dig en teoretisk förståelse som bättre förklarar fenomenet vill vi också skicka med några konkreta tips:
- Koldioxidretention vid syrgasbehandling av kroniskt underventilerade patienter verkar orsakas av tre saker: minskad minutventilation på grund av hypoxisk drive, dysreglerat ventilation/perfusionsmatchning, och haldaneffekten (se bild nedan)
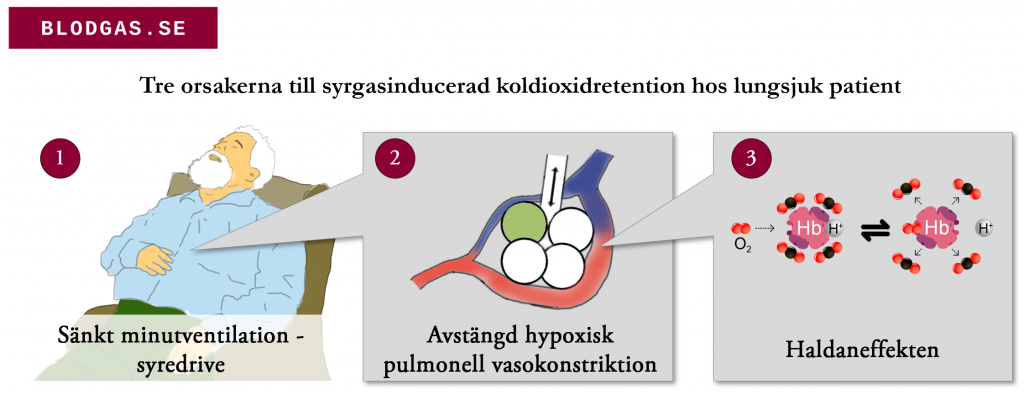
- Andningsfrekvens är en dålig pseudovariabel för pCO2 retention – så följ effekterna av syrgastillförsel med upprepade blodgaser
- Även icke-KOLare kan retinera! Alla lungsjukdomar som medför långvarig alveolär dysfunktion (vilket orsakar en fysiologisk HPV och/eller kroniska hyperkapné) kan retinera vid syrgastillförsel
- Behandla alltid hypoxi – hyperkapné kan man alltid lösa senare! 88-92% är ett rimligt målvärde för dessa patienter, och vi kommer att skriva mer om det inom kort…
Och om du vill läsa på mera: börja med [Calverly 2000] och [Abdo 2012]!
Referenser
- Christiansen J, Douglas CG, Haldane JS. The absorption and dissociation of carbon dioxide by human blood. J Physiol. 1914 Jul 14;48(4):244-71.
- Donald K, Simpson T, Michmicaelh J, Lennox B. Neurologic effects of oxygen. 1949 Dec 3; 6588(254): 1056-1057
- Campbell EJ. Respiratory Failure. Br Med J. 1965 Jun 5;1(5448):1451-60.
- Lenfant C. Arterial-alveolar difference in PCO2 during air and oxygen breathing. J Appl Physiol. 1966 Jul;21(4):1356-62.
- Campbell EJ. The J. Burns Amberson Lecture. The management of acute respiratory failure in chronic bronchitis and emphysema. Am Rev Respir Dis. 1967 Oct;96(4):626-39.
- Aubier M, Murciano D, Fournier M, Milic-Emili J, Pariente R, Derenne JP. Central respiratory drive in acute respiratory failure of patients with chronic obstructive pulmonary disease. 1980 Aubier Am Rev Respir Dis. 1980 Aug;122(2):191-9.
- Aubier M, Murciano D, Milic-Emili J, Touaty E, Daghfous J, Pariente R, Derenne JP. Effects of the administration of O2 on ventilation and blood gases in patients with chronic obstructive pulmonary disease during acute respiratory failure. Am Rev Respir Dis. 1980 Nov;122(5):747-54.
- Luft UC, Mostyn EM, Loeppky JA, Venters MD. Contribution of the Haldane effect to the rise of arterial Pco2 in hypoxic patients breathing oxygen. Crit Care Med. 1981 Jan;9(1):32-7.
- Sassoon CS, Hassell KT, Mahutte CK. Hyperoxic-induced hypercapnia in stable chronic obstructive pulmonary disease. Am Rev Respir Dis. 1987 Apr;135(4):907-11.
- Dick CR, Liu Z, Sassoon CS, Berry RB, Mahutte CK. O2-induced change in ventilation and ventilatory drive in COPD. Am J Respir Crit Care Med. 1997 Feb;155(2):609-14.
- Robinson TD, Freiberg DB, Regnis JA, Young IH. The role of hypoventilation and ventilation-perfusion redistribution in oxygen-induced hypercapnia during acute exacerbations of chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2000 May;161(5):1524-9.
- Spyer KM, Gourine AV. Chemosensory pathways in the brainstem controlling cardiorespiratory activity. Philos Trans R Soc Lond B Biol Sci. 2009 Sep 12;364(1529):2603-10.
- Gay PC, Edmonds LC. Severe hypercapnia after low-flow oxygen therapy in patients with neuromuscular disease and diaphragmatic dysfunction. Mayo Clin Proc. 1995 Apr;70(4):327-30.
- Budinger GRS, Mutlu GM. Balancing the risks and benefits of oxygen therapy in critically III adults. Chest. 2013 Apr;143(4):1151-1162.
- Abdo WF, Heunks LM. Oxygen-induced hypercapnia in COPD: myths and facts. Crit Care. 2012 Oct 29;16(5):323.
- Calverley PM. Oxygen-induced hypercapnia revisited. Lancet. 2000 Nov 4;356(9241):1538-9.