Base excess (BE) är ett värde som svaras ut på de flesta system som används för patientnära analys av blodgaser i Sverige idag. BE är en viktig pusselbit vid analys av syra-basstatus och i det här inlägget går Mikael på djupet i ämnet och har även gjort ett efterföljande quiz där du kan testa dina kunskaper inom blodgastolkning. Läs vidare för att lära dig mer om hur base excess beräknas, hur det kan användas vid analys av syra-basstatus, hur du beräknar om sekundära kompensatoriska mekanismer för pH-balans är tillräckliga, och hur du kan göra för att avslöja om det föreligger flera syra-basrubbningar samtidigt. Inlägget spänner över ett brett fält med allt ifrån en historisk exposé till nördiga formler och exempel med patientfall. Tyck gärna till och kommentera inlägget eller återkoppla till oss via mail eller på hemsidan. Base excess, nyckeln till kombinerade syra-basrubbningar
Sammanfattning och viktigaste punkter
- BE är ett kalkylerat värde och representerar ett index över den icke-respiratoriska (metabola) komponenten av syra-basbalansen och bör i första hand tolkas i relation till pH och pCO2 vid bedömning av syra-basstatus.
- Normalt referensintervall är mellan +3 och -3 mmol/liter. Om BE > +3 mmol/l föreligger metabol alkalos. Om BE < -3 mmol/l föreligger metabol acidos. Ju större avvikelse från normalintervallet, desto allvarligare underliggande rubbning
- Fysiologiska lagar reglerar förhållandet mellan primär rubbning och sekundär kompensation, således kan förväntad storlek på sekundär kompensation beräknas.
- Om nivån av sekundär kompensation avviker från det förväntade bör kombinerade syra-basrubbningar eller multipla sjukdomsorsaker misstänkas.
- Anjongap albumin och laktat bör regelmässigt tas i beaktande om det kompensatoriska svaret avviker från det förväntade och beroende på dessa värden kan utredningen fokuseras på underliggande tillstånd.
- Vid mycket låga S-albuminnivåer bör BE korrigeras enligt formeln 0,25 x (42 – [S-albumin g/L)]
Bakgrund och historia
Konceptet med base excess kan historiskt spåras tillbaka till 1950 och 1960-talen. Under ett polioutbrott i Danmark noterades att poliodrabbade patienter hade mycket höga halter av bikarbonat i blodet och man trodde först att denna metabola alkalos av oklar genes var associerad med poliosjukdomen i sig. Senare under polioutbrottet fann man att höga halter av bikarbonat hos poliopatienterna snarare berodde på höga halter av koldioxid sekundärt till neuromuskulär påverkan och nedsatt ventilation. Man misstänkte således att de höga HCO3-nivåerna var en kompensatorisk metabol alkalos, och man startade på basen av de insikterna omfattande program för manuell ventilation av poliodrabbade, vilket tros ha bidragit till många patienter överlevde. Så sent som på 1950 och 60-talet var det begränsad tillgång till laboratorieanalyser av syra-basbalansen och det fanns i princip ingen tillgång till mekanisk ventilation i respirator på det sätt som vi känner till idag. Slutsatserna man drog vid polioutbrottet i Danmark på 50-talet var att primära rubbningar i syra-basbalansen har sekundära kompensatoriska mekanismer. Detta är en essentiell princip och grundförutsättning när vi analyserar syra-basbalansen och vid blodgasanalys även idag [1].
Olika sätt att bedöma den metabola komponenten i syra-basbalansen
Det finns olika sätt att bedöma den metabola komponenten i syra-basbalansen som skiljer sig lite åt. Vi redogör nedan översiktligt för tre metoder och kommenterar kortfattat fördelar och nackdelar.
1. CO2/HCO3 – metoden.
Kallas även för “the boston approach”. Bygger helt på Henderson-Hasselbachformeln och bygger på data från en stor kohort stabila patienter med kända med “kompenserade syra-basrubbningar. Denna metod är enkel och lämpar sig väl för enklare syra-basrubbningar, men eftersom HCO3 påverkas av PaCO2 blir omfattningen av andra syror än koldioxid svårare att bedöma. CO2/HCO3-metoden är mest användbar för att avgöra habituellt pCO2 hos patienter med kronisk respiratorisk insufficiens som vid t e x KOL [10].
2. Base excess/deficit – metoden
Kallas också den danska metoden eller “Köpenhams-metoden”. Vi går igenom Base Excess-metoden i detalj nedan, men kortfattat kan den anses vara mindre påverkad av den respiratoriska komponenten av syra-basbalansen och därmed bättre spegla den metabola komponenten. Svagheter som förts fram är att värdena kan bli osäkra vid låga albuminnivåer och att den bygger på en in vitro modell [1,2,10].
3. Anjongap-metoden
Den här metoden försöker adressera svagheterna i både boston- och Köpenhamnsmetoderna och bygger på principen om elektroneutralitet. Anjongapet (AG) är skillnaden mellan positivt och negativt laddade joner i extracellullärvätskan och beräknas AG = ( [Na] + [K]) – ([Cl] + [HCO3]) och är normalt mellan 12-16 mmol/L (beroende på lokala referensvärden). Vid metabol acidos ansamlas anjoner som t e x laktat och ketoner vilka inte ingår i ekvationen vilket ökar anjongapet pga att syror med negativ laddning leder till lägre HCO3-nivåer då fysiologiska processer försöker bibehålla elektroneutralitet. Svagheter med den här metoden kan vara att värdera vilket värde som bör anses vara ett normalt anjongap och beräkningarna påverkas även av albumin och fosfat, samt att att bikarbonatnivåerna kan påverkas av yttre påverkan på pCO2 som vid tex mekanisk ventilation [10].
Definition av base excess
Den biokemiska definitionen av base excess som hänvisas till i litteraturen brukar anges som att base excess kan definieras som den koncentration av stark syra eller stark bas, vilken krävs för att, i en in-vitromiljö, i ett prov med helblod återställa pH till 7,40 medan pCO2 i samma prov hålls konstant vid 5,32 kPa och provets temperatur hålls konstant vid 37 grader celsius.
Genom att pCO2 hålls konstant måste alla förändringar i pH bero på den icke-respiratoriska komponenten av syra-basbalansen. Om det inte sker någon förändring av pH vid konstant pCO2 behövs ingen tillsats av stark syra/bas för att hålla pH vid 7,40 och base excess är således 0 mmol/l. Om base excess är +6 mmol/l behövs stark syra tillsättas och vid BE -6 mmol/l behövs stark bas. Det senare benämns ibland även för base deficit.
I litteraturen hänvisas även till olika typer av base excess som skiljer sig en aning åt, men på de flesta blodgasanalyser som används i klinisk praxis, är Standard Base Excess (SBE) det som normalt används och benämns base excess. SBE kallas även base excess i extracellullärvätskan och definieras som summan av den buffrande kapaciteten i extracellullärvätskan, och utgörs av hemoglobin, plasmaproteiner, fosfat och bikarbonat. SBE kommer fortsättningsvis att kallas base excess i den här artikeln.
Base excess kan förenklat anses representera den icke-respiratoriska komponenten i syra-basbalansen (metabol alkalos och metabol acidos) och hur mycket värdet avviker från normalintervallet speglar allvarlighetsgraden av den underliggande icke-respiratoriska syra-basrubbningen. De flesta blodgasapparater beräknar idag base excess (SBE) baserat på en modifiering av Van Slyke-ekvationen: SBE = (HCO3 − 24.4) + (2.3 x Hb + 7.7) x (pH − 7.4) x (1 − 0.023 x Hb). I beräkningar av SBE antas ett Hb-värde schablonmässigt på 30-50 g/L för att minimera påverkan av skillnader i Hb-värdet. Svaret ges i mmol/liter och normalintervallet är mellan 0 +- 3 mmol/liter [1,10].
Base excess normalvärden
- Normalvärde för BE är +- 3 mmol/liter
- Metabol acidos definieras som BE – 3 mmol/l eller lägre
- Metabol alkalos definieras som BE +3 mmol/l eller högre.
Tre principiella steg vid bedömning av Base Excess vid blodgasanalys
Base excess kan användas som en del i analysen av störningar i syra-basbalansen och analysen med base excess kan delas in i tre principiella steg
- Bedöm av base excess i relation till pH och pCO2
- Vilken är den primära stora-basrubbningen?)
- Föreligger adekvat kompensation
- Beräkna kompensation i relation till den primära rubbningen och bedöm enligt tabell 1 nedan? Om nej gå vidare till punkt tre.
- Analysera orsaker till aktuellt base excess i relation till förväntat base excess, korrigera för albumin och beräkna anjongap
- Beror avvikande BE på avvikande S-Na, S-Cl eller S-Albumin eller alla tre?
- Är anjongapet förhöjt vilket indikerar en kombinerad metabol rubbning?
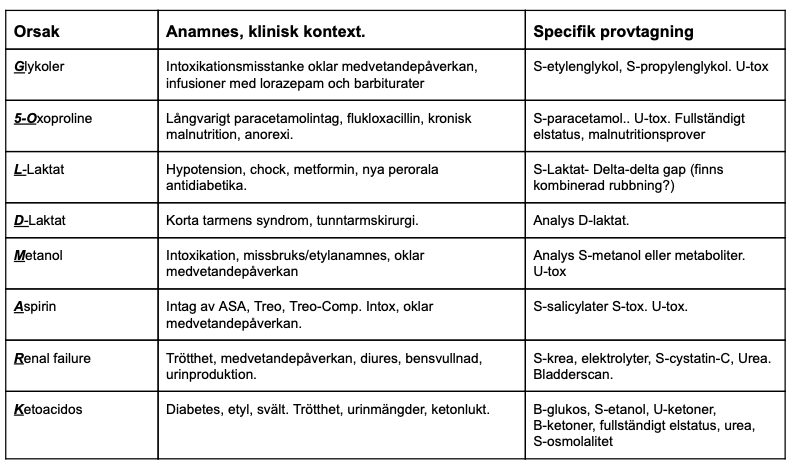
Ibland förekommer flera syra-basrubbningar samtidigt och det kan då vara svårt att förstå vilken rubbning som är den primära. Metabola rubbningar av syra-basbalansen utan samtidigt respiratorisk kompensation kan leda till särskilt allvarliga syra-basrubbningar och kräver ofta snabba och kraftfulla behandlingsåtgärder som t. ex. mekanisk ventilation i respirator eller intensivvård.
Beräkning av adekvat kompensatoriskt svar på primär syra-basrubbning
I en metaanalys från 1998 undersökte författarna relationen mellan pCO2 och base excess i historiska studier och slutsatserna i artikeln ledde fram till fyra principer eller regler som kan användas för att ställa upp ekvationer och beräkna om en adekvat kompensation föreligger [3].
Tabell 1. Syra-basrubbningar och förväntat kompensatoriskt svar (sammanställd från ref 1,2,3)
Klicka på länken nedan för nedladdningsbar högupplöst PDF
Beräkning-av-kompensatoriskt-svar
Nedbrytning av beståndsdelar som påverkar base excess och kombinerade metabola syra-basrubbningar
Man kan utföra omfattande matematiska beräkningar för att räkna ut hur olika ämnen som HCO3, Cl, albumin och Na var för sig påverkar base excess, men vi rekommenderar en enklare variant där man räknar ut albuminkorrigerat base excess och vid oklara mer komplicerade svårbedömda rubbnignar, även albuminkorrigerat anjongap.
Albumin och base excess
Albumin är en neg laddad molekyl och ett av de blodproteiner som ingår i kroppens pool av buffrande baser. Vid låga albuminvärden (som ofta ses hos kritiskt sjuka) riskerar patienter att utveckla metabol alkalos pga samtidig stegring av HCO3, då kroppens fysiologiska processer försöker upprätthålla elektroneutralitet [5,6]. Det handlar om en påverkan på base excess med ca 1,25 mmol/L per 5g/L albumin [5]. Dessa patienter utvecklar då ofta en metabol alkalos med lågt anjongap [6]
Base excess beräkningar enligt Van Slykes formel tar oftast inte hänsyn till låga albuminnivåer, vilka kan påverka BE-värdet. Frågan blir intressant när man sätter cut-off värdet för metabol acidos/alkalos hos patienter med mycket låga albuminnivåer eller beräknar skillnaden mellan faktisk base excess och uppmätt base excess [4]. Hur BE påverkas av av albumin kan beräknas enligt formeln
albumineffekt på base excess = 0,25 x (42 – [S-albumin /g/L]) och formeln bygger på studier av Figge et al [7,8]
Exempel: S-albumin är 28 g/L, påverkan på BE blir således 0,25 X(42-28)= 0,25 x 14 = 3,5 mEq/L[5].
Vid låga albuminnivåer (som ofta ses hos kritiskt sjuka) finns därför en risk att överskatta uppmätt base excess jämfört med faktiskt albuminkorrigerat base excess och därmed missa en metabol acidos pga ett falskt normalt anjongap [5].
Albuminkorrigerat anjongap
Anjongapet är en viktig variabel i syra-basanalysen för att avslöja ämnen i blodet som kan ge upphov till metabol acidos . Anjongapet kan beräknas på lite olika sätt men oftast enligt formeln = (Na ) – (Cl + HCO3). Eftersom kroppen strävar efter elektroneutralitet, talar ett högt anjongap för att det finns någon syra i blodet som påverkar relationen mellan positivt och negativt laddade joner. Vanliga kliniska tillstånd med ett högt anjongap är t ex diabetes ketoacidos där betahydroxysmörsyra påverkar anjongapet, intoxikation med salicylater, laktatstegring vid epileptiska kramper och uremi vid njursvikt. Vid okomplicerade sådana tillstånd ses även motsvarande pH-påverkan; vi ser en acidemi (lågt pH) och en metabol acidos BE < -3). Albumin kan påverka tolkningen av anjongapet och i en artikel i NEJM från 2018 rekommenderas att man ökar anjongapet med 2,5 mmol/l för varje förändring av albumin med 10g/L från “normalvärdet” 40g/L[3]. Huruvida anjongapet ska korrigeras för albumin eller inte är enligt vår uppfattning mer omdebatterat än albuminkorrigerat base excess. Enligt samma teoretiska modell som för albuminkorrigerat base excess förespråkar vissa ett albuminkorrigerat anjongap. Dock har detta i studier inte visats sig ha någon större klinisk fördel för att upptäcka t e x lätt till måttlig laktacidos [9], men dessa studier gjordes innan laktat regelmässigt analyserades på blodgasen, vilket oftast är fallet idag. Få studier är gjorda på syra-basbedömningar vid låga albuminnivåer och man kan därför, som en försiktig approach oberoende av uppmätt anjongap, riskbedömma för ansamling av ketoner, uremiska produkter, laktat eller om klinisk misstanke finns även andra syror (ex salicylat, toxiska alkoholer).
Exempel på kliniska tillstånd där kombinerade syra-basrubbningar kan förekomma
Exempel 1 optiatintoxikation och diabetes ketoacidos.
Drogmissbrukande patienter riskerar oftare att drabbas av medicinska komplikationer till kroniska sjudomar som t e x diabetes. Ett exempel på en patient med kombinerad syrabasrubbning är en patient med diabetes som pga drogmissbruk slarvat med insulinet och drabbats av en ketoacidos (metabol acidos) och samtidig opiatöverdos med koldioxidretention. Den patienten kommer att ha en samtidigt respiratorisk- och metabol acidos istället för en kompensatorisk respiratorisk alkalos vilket leder till en allvarlig pH rubbning med mycket lågt pH som följd.E
Exempel 2. Diabetes ketoacidos med uttalade kräkningar
En patient med diabetes ketoacidos (metabol acidos) som har samtidiga kräkningar som leder till förlust av kloridjoner och metabol alkalos. Den patienten kommer att ha en kombinerad metabol acidos och alkalos, vilket kan avslöjas via ett högt anjongap pga ketoner (syra) i blodet. Det bör således misstänkas om anamnesen och övriga blodprover starkt talar för diabetes ketoacidos men pH och BE avviker från det förväntade vid tillståndet
Exempel 3. Metabol acidos och svår KOL
Vid tIllstånd som t e x sepsis med laktatstegring, generell kramp eller annan metabol acidos är den respiratoriska kompensationen en viktig funktion för att minska den metabola påverkan på syra-basbalansen. KOL-patienten kommer pga av sin kroniska lungsjukdom ha mindre marginaler att respiratoriskt kompensera för den metabola komponenten, vilket ger större påverkan på syra-basbalansen än motsvarande metabol rubbning hos en lungfrisk patient.
Dessa patienter kommer även att vara svårare att räkna på rubbningarna eftersom de har en kronisk kompensatorisk metabol alkalos som utgångsläge pga sin kroniska koldioxidretention. De kan således ha en relativ metabol acidos trots ett normalt eller positivt BE, men deras anjongap kommer då att vara högt pga den nytillkomna syran i blodet.
Referenser:
- Berend K. Diagnostic use of base excess in acid-base disorders. New Eng J Med 2018; 378: 1419-28.
- https://acutecaretesting.org/-/media/acutecaretesting/files/pdf/base-excess–the-basics(1).pdf
- Schlichtig R, Grogono A, Severinghaus J. Human pCO2(a) and standard base excess compensation for acid-base imbalance. Crit Care Med 1998; 26: 1173-79.
- M. Park. Clinical utility of standard base excess in the diagnosis and interpretation of metabolic acidosis in critically ill patients.Braz J Med Biol Res 41(3) 2008
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3883200/
- Vincent et al. Albumin administration in the acutely ill: what is new and where next? Critical Care 20142014, 18:23
- Figge et al. Anion gap and hypoalbuminemia. Crit Care Med. 1998 Nov;26(11):1807-10.
- Figge et al. Serum proteins and acid-base equilibria: a follow-up. J Lab Clin Med. 1992 Nov;120(5):713-9.
- Dinh et al. Correcting the anion gap for hypoalbuminaemia does not improve detection of hyperlactataemia. Emerg Med J. 2006 Aug; 23(8): 627–629.
- Kishen R. Facing acid–base disorders in the third millennium – the Stewart approach revisited. International Journal of Nephrology and Renovascular Disease 2014:7 209–217