En lätt medvetandepåverkad och förvirrad patient, allt ser bra ut till jag får en blodgas i handen med pH 7.1 och laktat på 15. Vad har jag missat, var ska jag börja? Frågorna hopar sig och patienten ligger medvetandesänkt och kan inte ge några svar på mina frågor. Är det så enkelt som en kramp i hemmet eller ska jag aggressivt utreda tarmischemi?
Som med alla tillstånd blir det enklare om man har ett kortare samling diagnoser att överväga. Vid stegrade laktatvärden är det en stor skillnad på 3 och 11. I detta inlägg går jag igenom de mer extrema värdena. Dessa definieras ofta som >10mmol/L. Är man orolig är >8mmol/L en bra gräns.
Sammanfattning
-
-
- Behandla avvikande vitalparametrar
- Utred i första hand utifrån klinisk bild
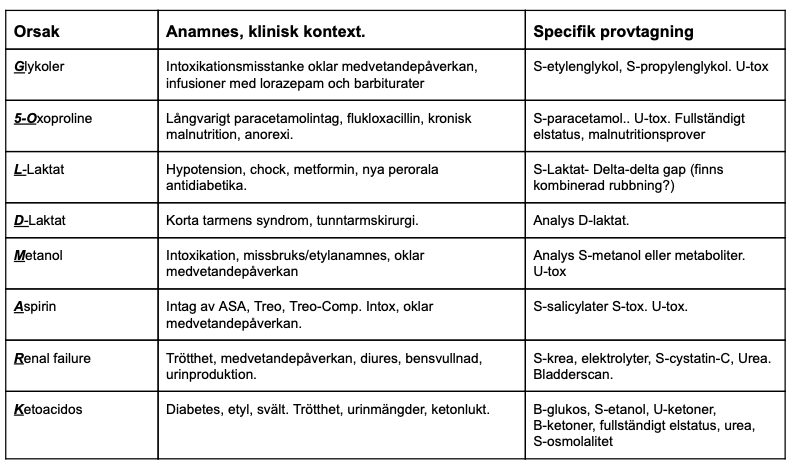
- Bred labutredning (inkl salicylat och toxiska alkoholer)
-
-
-
- Läs på om handläggning och lokala riktlinjer/logistik för akuta tillstånd där snabb handläggning påverkar prognos (som brandrök, tarmischemi, chock)
-
- Vanligaste orsakerna: chocktillstånd (septisk, kardiogen chock, blödning), HLR, leversvikt, tarmischemi och kramp
- Flera samtidiga tillstånd förekommer ofta
-
Indelning och terminologi
-
-
- Normalt: 0-2 (metodberoende)
-
- Lätt förhöjt: 2-4
-
- Måttligt förhöjt: 4-8/10
-
- Uttalat förhöjt: >8-10
-
- (Exceptionellt): ≈ >20
- Metodens övre referens ofta 30mmol/L
-
Nivåerna i denna indelning får ses som en grov uppdelning. Poängen är att ju högre laktatvärden desto smalare blir listan på differentialdiagnoser. Den bäst definierade gränsen är 4 som ibland kallas OBLA, onset of blood lactate accumulation, vilket alltså är nivån då laktat tenderar att ansamlas. Laktat på 4 har dock en mycket bred bakgrund och kommer inte täckas i helhet i detta inlägg.
Laktacidos är en problematisk term som bör undvikas då själva laktatet i sig ej ger acidos (se dessa lång externa inlägg del 1 och 2), det är bättre att tänka på det i termer av laktatstegring. Exempelvis ger intensiv träning laktatstegring men inte en grav acidos. Detta framkommer dock sällan i fallrapporter som oftast beskriver tillståndet som ”lactic acidosis”.
Vilka är de vanliga orsakerna?
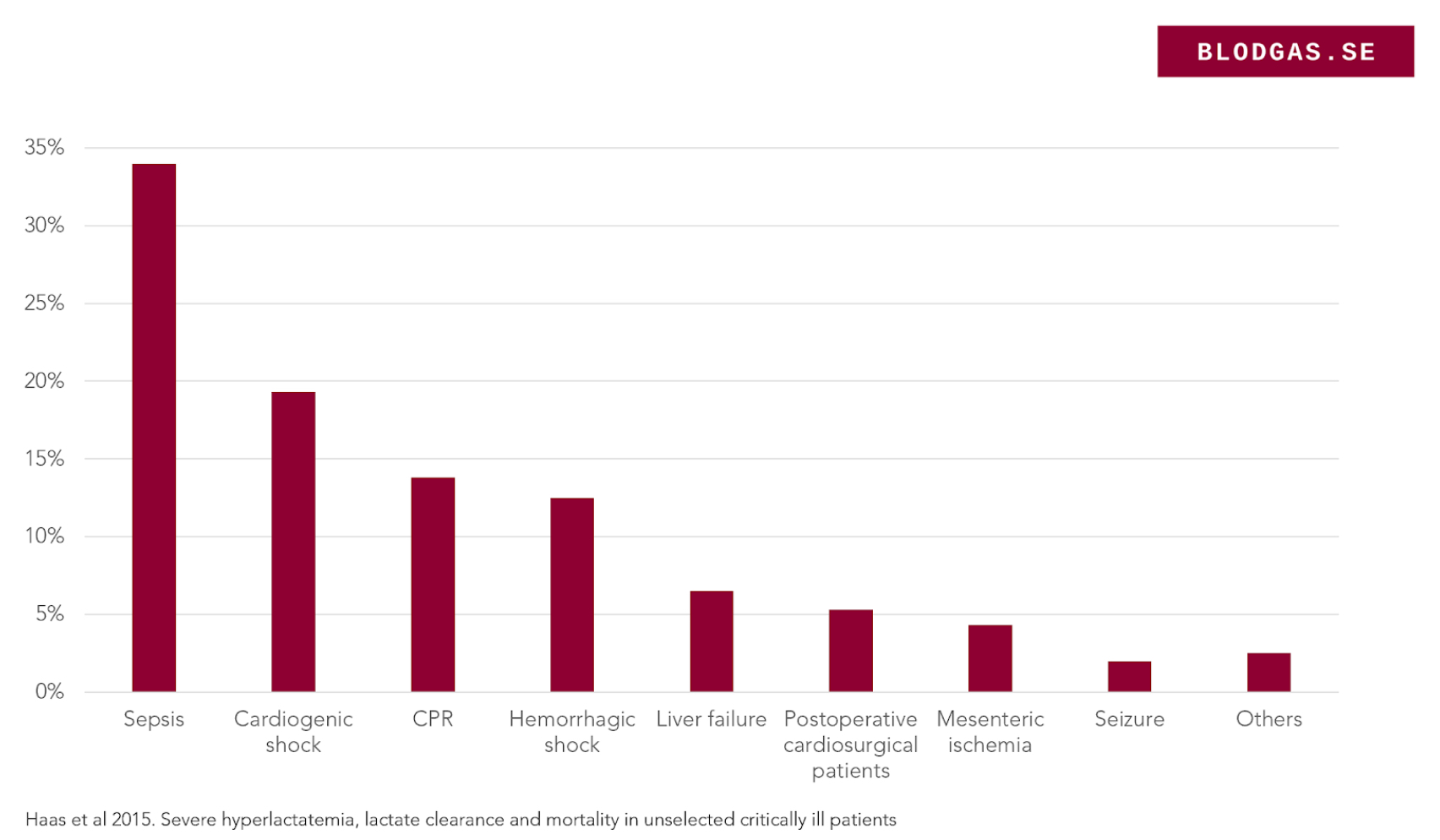
I en studie över ca 14000 intensivvårdspatienter identifierades 400 med laktat >10mmol, bland de vanligaste förklaringarna sågs sepsis, kardiogen chock, post HLR, blödning och leversvikt.
Utredning
I första hand driven av sjukhistoria och status. För medvetslösa patienter är listan på tänkbara orsaker lång och man bör inte låsa sig vid en diagnos som infektion. Tittar vi igen på diagrammet ovan kan vi ofta ta bort flera vanliga orsaker. Exempelvis vid någorlunda normala vitalparametrar försvinner kardiogen chock, post HLR, blödningschock och ganska ofta sepsis. Hos vår patient blir det därför viktigare att utreda andra orsaker.
I första hand bör man normalisera vitalparametrar som saturation och blodtryck samt behandla vissa akuta faktorer, som antidot vid misstanke om cyanid. Är chock utesluten kan nedanstående ledtrådar hjälpa att avgränsa. Genomför annars en bred labutredning, eventuell röntgen samt titta under respektive rubrik nedan.
Ledtrådar till uttalat förhöjt laktat
-
-
- Chock: typ av chock (sepsis/distributiv, blödning, kardiogen). Tarmischemi (sent, dvs manifest ischemi)
-
- Feber: sepsis i första hand. Ovanligare med hyperterma tillstånd som serotonergt syndrom och malignt neuroleptikasyndrom vilka även kan vara förenade med rhabdomyolys.
-
- Läkemedel: metformin, HIV/hepatit-läkemedel, nitroprussid, propofol, salicylat
-
- Medvetslöshet: kramp, leversvikt och toxikologiska orsaker bör utredas i första hand
- Smärta: finns tecken på extremitets- eller tarmischemi?
-
Labutredning oklara fall: Hb, tpk, lpk, leverstatus (ASAT, ALAT, ALP, bilirubin), krea, Na, K, troponin, CRP, PK, albumin, myoglobin.
Toxikologi: etanol, metanol, etylenglykol
Radiologi: ofta av värde, DT thorax-buk kan förutom infektiösa tillstånd och annan orsak till chock påvisa större solida tumörer som lymfom
Finns uppenbar orsak?
-
-
- Hjärtstopp
-
- Hög muskelaktivitet (direkt från tävling, fasthållen och motoriskt orolig med hög muskelaktivitet)
- Krampanfall
-
Specifika orsaker
Nedanstående är en översikt över tänkbara orsaker uppdelat efter typ.
Toxikologi
-
-
- Brandrök: cyanid (laktat >10 är användbart för misstanke), betydande CO eller mer mekaniska faktorer som luftvägshinder, lungödem av retande gaser
-
- Etylenglykol: ger höga laktat pga mätfel på vissa apparater då glykolat kan förväxlas. Ta laktat med annan metod ex till kemlab, stor diskrepans stöder diagnosen
-
- Metformin/MALA: kräver betydande njurfunktionspåverkan för ansamling
- Mitokondriella toxiner: exempelvis arsenik, men hit hör även cyanid med flera
- Betastimuleraring som massiv koffeinöverdosering
-
Metabolism
-
-
- Leversvikt: oftast dekompenserad leversvikt med en samvarierande faktor som sepsis. I en studie sågs ungefär dubbelt så höga laktatvärden vid akut hemodynamisk påverkan och samtidig leversvikt än de utan leversvikt. Leversvikt ensamt leder sällan till höga laktat även om författaren har sett enstaka fall med (svår) akut leversvikt och laktat >>10. Ett påtagligt högt laktatvärde hos patient med kronisk leversvikt ska därför ej bortförklaras som endast orsakat av leversvikt.
-
- Svår tiaminbrist: sällan ensam orsak men man bör frikostigt ge, särskilt vid svält, malnutrition och gastrointestinala sjukdomar där det kan finnas sänkt upptag
-
- Barn: misstänk medfödd metabol rubbning, särskilt om barnet är väldigt ungt. Medfödda metabola rubbningar har en tendens att bli mer uttalade vid stresstillstånd som infektion varför exempelvis en konstaterad pneumoni med oväntat högt laktat snarare bekräftar misstanken än utesluter det.
- Vuxna: ovanligare med medfödda metabola tillstånd men bör övervägas om annan faktor ej kan förklara (se Brisset et al eller Oster et al i referenslistan). Liksom hos barn kan ett stresstillstånd som infektion utlösa en annars okänd rubbning.
-
Cirkulation/ischemi
-
-
- Chocktillstånd inklusive sepsis
-
- Tarm: buksmärta > bukstatus?
-
- Extremitetsischemi
- Hjärtstopp
-
Onkologi
-
-
- Hematologi: lymfom och leukemi där tumörceller har sk Warburg-metabolism, dvs de får energi genom glykolys även vid normal syrgastillgång. Indikerar generellt en dålig prognos på grund av stor tumörmassa med hög tillväxt.
-
- Solida tumörer: ovanligt men enstaka fallrapporter finns (se Garia B et al i referenslistan). Något vanligare om levermetastaser (med därmed leverpåverkan)
- Feokromocytom: ingår som tumör men de höga halterna av katecholaminer ger snarare laktatstegring genom ett inducerat stresstillstånd än genom stor tumörbörda.
-
Stresstillstånd och muskelgenes
-
-
- Kramp / status epilepticus. Laktat normaliseras inom några timmar efter avslutad kramp
-
- Betydande högintensiv ansträngning (bör vara uppenbart), detta inkluderar exciterat delirium och fasthållning av motoriskt oroliga
- Massiv rhabdomyolys (författaren har sett laktat >30 vid kombinerad rhabdomyolys och leversvikt)
- Se betastimulerare under nästa rubrik
-
Läkemedel
-
-
- Diabetes: metformin (äldre biguanider är betydligt mer benägna till detta). Dialys rekommenderas som behandling. Man skiljer i litteraturen på MALA (metformin-associerad laktacidos) och MILA (metformin-inducerad lactic acidosis)
-
- Nukleosid/nukleotidanaloger: används både vid HIV och hepatit. FASS
-
- Antibiotika: linezolid
- Psykiatri: klozapin, välkänt att det kan ge agranulocytos, myokardit med flera tillstånd som sekundärt kan ge uttalad laktacidos
- Betastimulerare som adrenalin (im, infusion), koffein (massiv överdosering) kan i enstaka fall ge laktat >10. Vid normala doser dock oftast 0-4mmol/L.
-
Kombinationer
I många fallrapporter rörande uttalad laktatstegring finns flera utlösande faktorer, några vanliga kombinationer är
-
-
- Chocktillstånd + organdysfunktion (ex leversvikt) ± sepsis
-
- Chocktillstånd + läkemedel (metformin, HIV, hepatit, vissa antibiotika är vanligast)
-
- Genetiskt tillstånd + stressfaktor (infektion, trauma)
- Leversvikt + läkemedel ± infektion/chock
-
Sammanfattning
Extremt förhöjda laktatvärden är oftast uttryck för en allvarlig underliggande sjukdom eller tillförsel av exogen syra. Vanligaste orsakerna till värden >10mmol/L är chocktillstånd, kramp, leversvikt, tarmischemi och efter HLR. På grund av den höga mortaliteten associerat med grav laktatstegring måste ofta diagnostik och terapi ske samtidigt. Förutom enskilda sjukdomar leder ofta kombination av flera laktatgenererande processer ofta till påtagligt höga värden.
Uppdatering
1/9 2020: Uppdaterade nomenklatur, dvs skilja laktatstegring från laktacidos. Lade till höga doser betastimulerare och koffeinöverdos som orsak.
Referenser
Alsunaid SR, Ashraf H, Soubani AO. Tenofovir alafenamide associated fatal lactic acidosis in an autologous hematopoietic stem cell transplant recipient. Transplant infectious disease. 2018; 20(5):e12960. [pubmed]
Andersen LW, Mackenhauer J, Roberts JC, Berg KM, Cocchi MN, Donnino MW. Etiology and therapeutic approach to elevated lactate levels. Mayo Clinic proceedings. 2013; 88(10):1127-40. [pubmed]
Belani K, Leibowitz A, Bose S. Linezolid-Induced Lactic Acidosis Sets Stage for Surgery to Rule Out Mesenteric Ischemia: A Case Report. A&A practice. 2018; 11(4):93-95. [pubmed]
Brisset M, Béhin A, Pottier C, et al. Life-threatening lactic acidosis occurring in adults with mitochondrial disorders. Revue neurologique. 2019; 175(9):564-567. [pubmed]
Butt AA. Fatal lactic acidosis and pancreatitis associated with ribavirin and didanosine therapy. The AIDS reader. 2003; 13(7):344-8. [pubmed]
Corchia A, Wynckel A, Journet J, et al. Metformin-related lactic acidosis with acute kidney injury: results of a French observational multicenter study. Clin tox. 2019; [pubmed]
De Jonghe B, Cheval C, Misset B, et al. Relationship between blood lactate and early hepatic dysfunction in acute circulatory failure. J crit care. 1999; 14(1):7-11. [pubmed]
Gharia B, Seegobin K, Mahida H, Shaikh M, Matthews Hew T, Pham D. Fatal Type B Lactic Acidosis Associated With Metastatic Colorectal Cancer: A Case Report With Review of Literature, Pathogenesis, and Treatment. J investigative medicine high impact case reports. ; 6:2324709618788101. [pubmed]
Haas SA, Lange T, Saugel B, et al. Severe hyperlactatemia, lactate clearance and mortality in unselected critically ill patients. Intensive care medicine. 2016; 42(2):202-10. [pubmed]
John M, Mallal S. Hyperlactatemia syndromes in people with HIV infection. Curr opin inf dis. 2002; 15(1):23-9. [pubmed]
Koren W, Kreis Y, Duchowiczny K, et al. Lactic acidosis and fatal myocardial failure due to clozapine. The Annals of pharmacotherapy. 1997; 31(2):168-70. [pubmed]
Madias NE, Goorno WE, Herson S. Severe lactic acidosis as a presenting feature of pheochromocytoma. AJKD. 1987; 10(3):250-3. [pubmed]
Oster Y, Wexler ID, Heyman SN, Fried E. Recoverable, Record-High Lactic Acidosis in a Patient with Glycogen Storage Disease Type 1: A Mixed Type A and Type B Lactate Disorder. Case reports in medicine. 2016; 2016:4362743. [pubmed]
Pace C, Dagda R, Angermann J. Antioxidants Protect against Arsenic Induced Mitochondrial Cardio-Toxicity. Toxics. 2017; 5(4):. [pubmed]
Pazderkovák J, Kotora V, Dlouhý P, Bartoš H. [Linezolid-induced lactic acidosis – a brief overview with a case report]. Klinicka mikrobiologie a infekcni lekarstvi. 2019; 25(3):92-96. [pubmed]
Ruiz JP, Singh AK, Hart P. Type B lactic acidosis secondary to malignancy: case report, review of published cases, insights into pathogenesis, and prospects for therapy. TheScientificWorldJournal. 2011; 11:1316-24. [pubmed]
Sangeetha Gandhi, Priyanka Avinash Pophali, and Thomas E. Witzig. Elevated serum lactate in lymphoma: Not always infection. J Clin Oncol 2019 37:15_suppl, e19039-e19039
Sillos EM, Shenep JL, Burghen GA, Pui CH, Behm FG, Sandlund JT. Lactic acidosis: a metabolic complication of hematologic malignancies: case report and review of the literature. Cancer. 2001; 92(9):2237-46. [pubmed]
Tox & Hound. Tox and Hound – Fellow Friday – Whence the Protons of Lactic Acidosis?. EMCrit Blog. Published on July 24, 2020. Accessed on September 1st 2020. Available at [https://emcrit.org/toxhound/ff-lactic-acidosis/ ].
Tox & Hound. Tox and Hound – Fellow Friday – Whence the Protons of Lactic Acidosis, Part II. EMCrit Blog. Published on August 14, 2020. Accessed on September 1st 2020. Available at [https://emcrit.org/toxhound/ff-lactic-acidosis-redux/ ].
Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 2009; 324(5930):1029-33. [pubmed]